“Nada na vida deve ser temido, apenas compreendido”. Esta famosa frase da cientista polonesa Marie Curie ilustra bem a jornada dos pesquisadores que enveredaram pelo estudo da doença de Alzheimer. Informações do portal Alzheimer ‘s Association – principal organização mundial de saúde voluntária para combate, suporte e pesquisa sobre a doença – estimam que 44 milhões de pessoas sofram com demência no mundo, sendo um milhão delas no Brasil. O sintoma mais comum é a perda de memória, mas a doença afeta desde a resolução de problemas e execução de tarefas que antes eram fáceis, até mudanças de humor, confusão para identificar pessoas, lugares, eventos e até mesmo imagens. Ou seja, é como se a mente fosse se apagando.
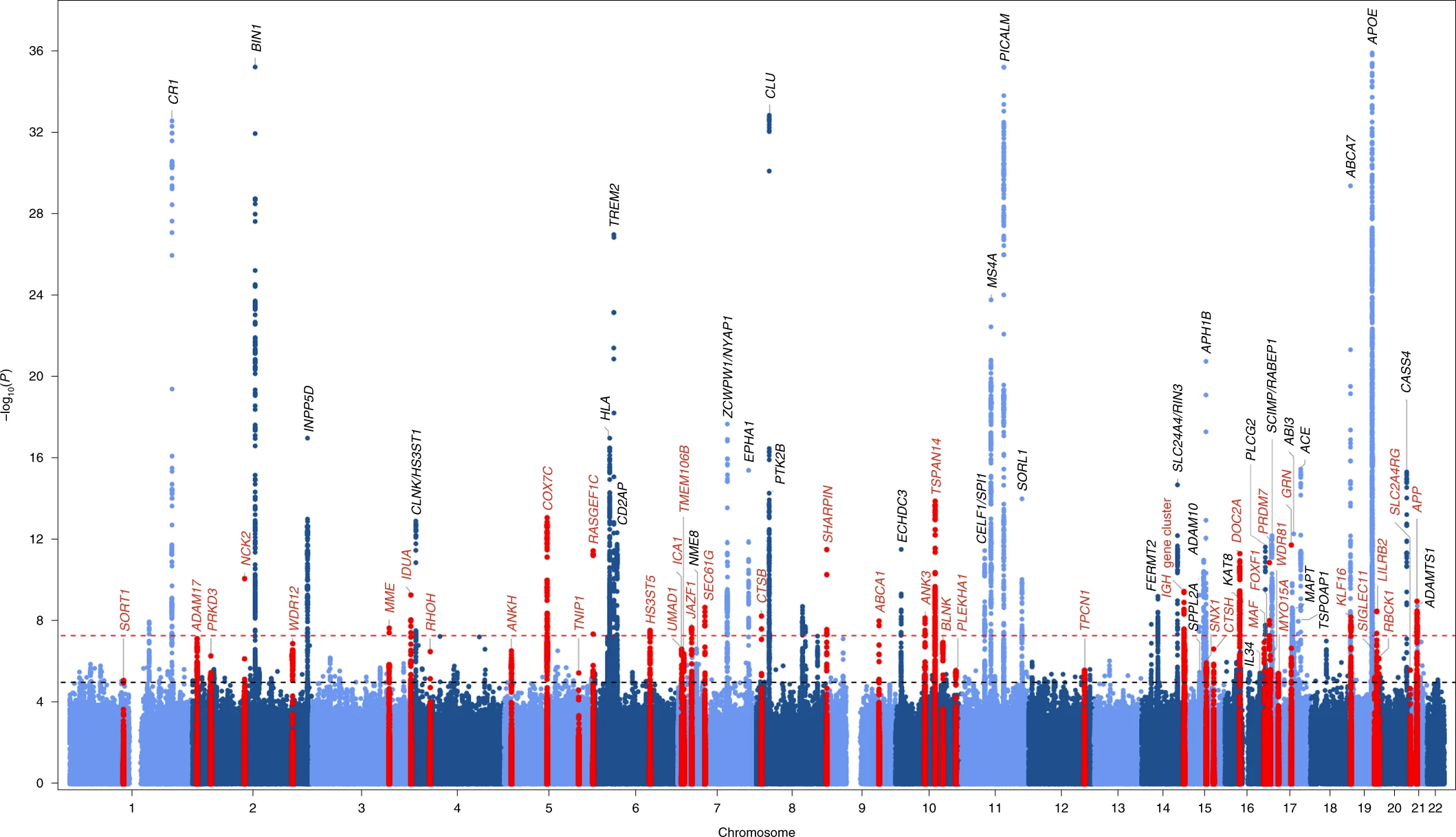
Uma pesquisa desenvolvida pelo consórcio European DNA bank for deciphering the missing heritability of Alzheimer’s disease (EADB), estabelecido em 2016, culminou com a importante descoberta de genes associados à doença de Alzheimer, relatada no artigo New insights into the genetic etiology of Alzheimer’s disease and related dementias (“Novas descobertas sobre a etiologia genética da doença de Alzheimer e demências relacionadas”, em tradução livre), publicado na revista científica britânica Nature Genetics em abril deste ano. O estudo identificou 75 genes que estão ligados a um risco aumentado para o desenvolvimento da doença de Alzheimer, 33 dos quais já eram conhecidos. A pesquisa envolveu cerca de 20 países, mais de 120 instituições – entre centros de pesquisa, hospitais e universidades – e 386 pesquisadores. Entre eles, o professor Marcos Costa, do Instituto do Cérebro da UFRN, único brasileiro a contribuir com o trabalho.
Graduado em Medicina e doutor em Fisiologia, ambos pela UFRJ, Marcos é professor adjunto da UFRN desde 2009 e integra o Instituto do Cérebro, onde chefia o laboratório de Neurobiologia Celular. Há três anos trabalha como professor visitante no Instituto Pasteur de Lille, na França, onde é o único brasileiro a integrar o estudo supracitado, no qual é co-autor. Este não é o primeiro trabalho que ele assina com o grupo: já foram cinco artigos, dos quais em três ele figura como pesquisador principal.
Este é o maior estudo de risco genético para a doença até hoje, e analisou os genomas de milhares de pessoas com diagnóstico clínico de Alzheimer e comparou com genes de indivíduos cognitivamente saudáveis. Os genomas foram fornecidos por clínicas em mais de 15 países membros da União Europeia, Argentina, Austrália, Brasil, Canadá, Islândia, Nigéria, Nova Zelândia, Reino Unido e Estados Unidos. Utilizando estes genes, os pesquisadores criaram um “score de risco genético” que poderá contribuir no futuro para identificar indivíduos com maior susceptibilidade de desenvolver a doença.
“A doença de Alzheimer é a principal causa de demência e tem um grande impacto na sociedade. A descoberta de genes associados com o aumento do risco de desenvolver a doença é um primeiro passo no sentido de entendermos a fisiopatologia da doença. O meu trabalho principal é estudar os processos biológicos regulados por estes genes em células neuronais e gliais humanas geradas a partir de células-tronco pluripotentes (iPSC), com o objetivo de elucidar os mecanismos patológicos da doença de Alzheimer e desenvolver novas abordagens terapêuticas”, detalha Costa.
Embora a descoberta seja animadora, seus usos ainda não são imediatos. “É óbvio que a gente quer que isso chegue nas clínicas e possa auxiliar o médico no diagnóstico diferencial da doença de Alzheimer, na identificação de seleção de grupos de risco e nas decisões terapêuticas. Existe uma série de possibilidades que podemos vislumbrar, mas devemos ter cautela para não promover uma corrida em busca de testes genômicos miraculosos que poderiam definir a chance de desenvolver Alzheimer. Esse ainda não é o caso. Nesse primeiro momento, o uso de testes genéticos ainda deve ser restrito para selecionar pacientes em ensaios clínicos com o objetivo de testar novos medicamentos, o que já é um enorme avanço”, explica o professor.
Além disso, Costa destaca que o aumento das chances em relação à população em geral é da ordem de cinco a dez por cento, em alguns casos chegando a 20% – números considerados significativos mas não determinantes. Ou seja, ainda que uma alteração genética seja identificada, isso não significa que o indivíduo irá desenvolver a doença de Alzheimer.
“No futuro, quando a gente souber exatamente o que cada um desses genes está afetando, vamos poder escolher o tratamento do paciente de acordo com as alterações genéticas identificadas nesse indivíduo. De fato, a genética sugere que a doença de Alzheimer seja altamente heterogênea, com diferentes alterações patológicas podendo provocar o mesmo desfecho clínico (perdas cognitivas). E, para cada uma dessas diferentes alterações patológicas, vão existir tratamentos mais eficazes e específicos. Mas, para chegarmos a este ponto, precisamos avançar mais no entendimento do papel biológico dos genes de risco e como eles contribuem para a doença”, alerta o docente.
Costa classifica os tratamentos disponíveis atualmente como limitados, pois embora considerados específicos para a doença, acabam não sendo satisfatórios. “Na verdade, são tratamentos que envolvem sistemas de neurotransmissores muito amplos no cérebro e causam uma série de efeitos colaterais. Além disso, os benefícios em termos de ganho cognitivo são muito limitados. Isso acontece em parte porque, quando o paciente chega ao estágio de demência, normalmente já existe uma alteração – perda neuronal, perda de sinapses – que é muito grande no cérebro”, explica.
O estudo genético então é estratégico na antecipação necessária para permitir que as pessoas propensas ao desenvolvimento da doença de Alzheimer sejam diagnosticadas nos estágios mais iniciais. Para Costa, identificar e entender os genes é importante porque vai ser possível compreender o que acontece antes de chegar à demência e, a partir disso, pensar em terapias profiláticas ou, ao menos, que comecem a ser usadas assim que os primeiros sinais de alterações cognitivas aparecerem.
Assim, a expectativa é que, a médio e longo prazo, seja possível não só selecionar, através da genética, os tratamentos mais adequados mas também, num segundo momento, detectar variantes genéticas nos descendentes e – dependendo do risco que esse gene confere e qual o processo biológico que ele estiver afetando – pensar numa terapia profilática para esses indivíduos.
Se em termos de prática clínica a aplicação desses resultados pode demorar, para o progresso da compreensão da doença de Alzheimer eles representam um grande avanço. “É sempre difícil avaliar objetivamente a importância do nosso trabalho. No entanto, acho que se pode dizer que este é um grande ponto de virada na compreensão da arquitetura genética da doença de Alzheimer. Devido à importância deste componente genético, este trabalho terá inevitavelmente um impacto importante sobre toda a comunidade científica que trabalha com esta doença”, prevê o professor Jean-Charles Lambert, diretor de pesquisa do Instituto Pasteur de Lille e um dos autores principais do estudo, além de coordenador da pesquisa.
Ele explica que o componente genético das formas comuns da doença de Alzheimer é muito alto, especialmente para uma doença associada ao envelhecimento. Entender esse componente genético é um dos principais desafios dos pesquisadores da doença de Alzheimer. “Em nosso estudo, validamos 33 fatores de risco genéticos da doença já conhecidos e detectamos 42 novas regiões de interesse. Assim, dobramos nosso conhecimento da genética das formas comuns de Alzheimer”, contabiliza Lambert. “Em geral, a imagem que uso para explicar o interesse da genética é esta: temos que ir a um poste que representa o que sabemos sobre a expressão clínica da doença, mas para chegar lá temos que avançar no escuro porque a luz não é forte o suficiente para nos mostrar o caminho a seguir, ou seja, os processos fisiopatológicos. A genética torna possível acender pequenas luzes em todos os lugares para iluminar o caminho certo a seguir”, ilustra.
É a primeira vez que o professor Lambert trabalha com um brasileiro e a parceria está afinada. “Marcos se juntou à minha equipe há três anos após um processo seletivo muito competitivo. Não sei se é uma característica brasileira ou simplesmente suas próprias qualidades, mas é realmente muito prazeroso trabalhar com ele. Além disso, ele é muito criativo, o que é necessário para poder fazer pesquisas de alto nível. Desde sua chegada, também tivemos dois brasileiros que ingressaram no laboratório e também são pessoas muito competentes. Estou, portanto, muito feliz com a conexão brasileira que acaba de ser estabelecida e tenho certeza de que vamos fortalecer nossos laços com o Brasil no futuro”, comenta o professor Lambert.
Infelizmente, o baixo investimento e os cortes orçamentários em Ciência, Tecnologia e Educação ao longo dos últimos anos impossibilita que o Brasil seja representado em estudos como esse de forma institucional, e não com apenas um cientista. “De maneira geral, os grandes estudos de associação genética são limitados ao estudo de populações europeias e norte-americanas. Praticamente não temos dados genéticos representativos dos brasileiros, demais latino-americanos, africanos e asiáticos, o que limita a identificação de possíveis variantes genéticas em populações específicas. A verdade é que nós estamos muito atrás e, certamente, se houvesse investimento financeiro suficiente em grupos de pesquisa no Brasil, para coletar dados clínicos de pacientes de forma sistemática e realizar o sequenciamento genômico, isso seria uma adição extremamente importante para o consórcio e, consequentemente, para o avanço da pesquisa sobre a doença de Alzheimer” analisa o professor Marcos Costa.
Fonte: Agecom/UFRN